6.1–6.9 mmol/L 的睡前血糖值可能提示空腹血糖受损或血糖控制临界状态,属于糖尿病前期的重要信号区间。
成年人在未进食至少8小时后的血糖(即空腹血糖)若为6.2 mmol/L,处于空腹血糖受损(IFG)范围内,表明机体对葡萄糖的代谢调节能力已出现早期异常,但尚未达到糖尿病的诊断阈值(≥7.0 mmol/L);而若6.2 mmol/L为睡前即刻测量值(非严格空腹),则需结合晚餐时间、食物种类与运动情况综合判断——若晚餐后距测量不足4小时,该数值可能属正常波动;若已间隔6小时以上仍维持在此水平,则高度提示基础胰岛素分泌不足或胰岛素抵抗增强,需进一步评估糖代谢状态。
一、临床界定与诊断标准差异
空腹血糖 vs 睡前血糖的时间定义
- 空腹血糖:指禁食8–12小时后清晨未进食状态下的静脉血浆葡萄糖值,是糖尿病筛查的金标准之一。
- 睡前血糖:临床中常作为夜间低血糖风险评估指标,其“空腹属性”取决于晚餐至测量的时间间隔。若距晚餐≥6小时且无加餐,其数值接近空腹状态,具备参考价值。
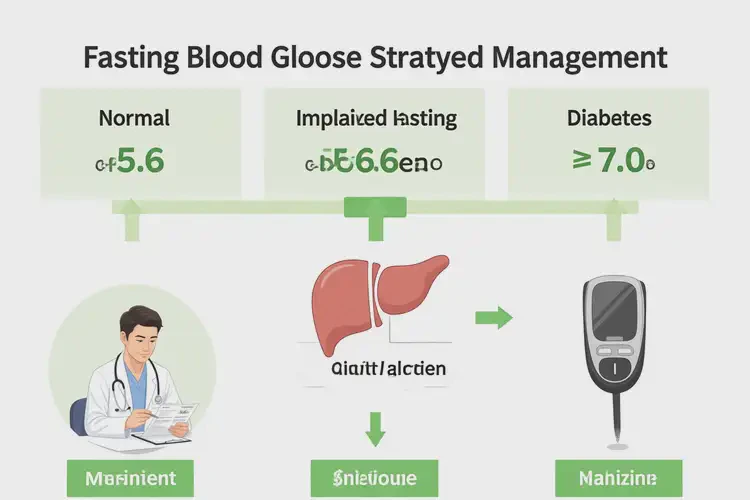
6.2 mmol/L 在不同诊断体系中的归类
根据现行国际主流指南,该数值的临床意义存在细微差异:诊断标准来源
正常空腹血糖上限
空腹血糖受损(IFG)范围
糖尿病诊断阈值
WHO(1999)
<6.1 mmol/L
6.1–6.9 mmol/L
≥7.0 mmol/L
ADA(美国糖尿病协会)
<5.6 mmol/L
5.6–6.9 mmol/L
≥7.0 mmol/L
中国《2型糖尿病防治指南》
<6.1 mmol/L
6.1–6.9 mmol/L
≥7.0 mmol/L
可见,按WHO与中国标准,6.2 mmol/L 明确落入空腹血糖受损区间;而按ADA更严格标准,则属糖尿病前期高风险的更早期阶段。
需排除的干扰因素
- 测量误差:家用血糖仪允许±15%误差,若为指血结果,建议复测或检测静脉血糖确认。
- 应激状态:近期感染、失眠、焦虑、慢性疼痛等可致应激性高血糖,呈一过性升高。
- 药物影响:糖皮质激素、噻嗪类利尿剂、β受体阻滞剂等可能升高血糖。
- 晚餐结构:高脂高碳水晚餐可延缓胃排空,致夜间血糖持续偏高。
二、潜在病理机制与风险评估
胰岛素抵抗为主导的代谢失衡
空腹血糖轻度升高常反映肝脏葡萄糖输出失控——胰岛素无法有效抑制肝糖异生与糖原分解,导致基础血糖“底值”抬升。此时胰岛β细胞尚能代偿性增加胰岛素分泌,故餐后血糖可能仍正常,但胰岛素敏感性指数(如HOMA-IR)已显著下降。进展为糖尿病的风险量化
IFG人群5年内进展为2型糖尿病的风险为25%–50%,显著高于血糖正常者;若同时合并糖耐量异常(IGT),风险可升至60%以上。IFG独立增加心血管疾病风险约1.5倍。是否需启动医学干预?
推荐进行以下三项检查以明确状态:- 空腹静脉血糖 + OGTT 2小时血糖:确诊是否合并IGT(“双前期”风险最高);
- 糖化血红蛋白(HbA1c):反映近2–3个月平均血糖,IFG者常见HbA1c 5.7%–6.4%;
- 血脂、血压、腰围:评估代谢综合征组分(满足3项及以上即诊断)。
三、规范应对策略与生活干预路径

分层管理目标设定
人群特征
睡前/空腹血糖目标推荐
干预强度
无高危因素的IFG
5.0–6.0 mmol/L
生活方式干预为主
合并肥胖/高血压/血脂异常
<5.6 mmol/L
生活方式+药物预防评估
已有ASCVD或CKD
个体化(通常5.0–7.0 mmol/L)
强化综合管理
核心生活方式干预措施
- 饮食调整:采用低升糖指数(低GI)、高膳食纤维(≥25 g/日)饮食,控制精制碳水占总热量<45%,晚餐碳水≤50 g,避免睡前3小时进食;
- 运动处方:每周≥150分钟中等强度有氧运动(如快走、游泳)+ 2次抗阻训练,餐后30分钟开始运动可显著降低夜间基础血糖;
- 体重管理:超重/肥胖者减轻初始体重5%–10%,即可改善胰岛素敏感性30%以上。
药物预防的适用条件
当满足以下任一条件时,可考虑二甲双胍作为预防用药(需医生评估):- BMI ≥35 kg/m²;
- 年龄<60岁且HbA1c ≥6.0%;
- 既往有妊娠糖尿病史;
- 生活方式干预6个月后血糖仍进行性升高。
即便单次检测值为6.2 mmol/L未达疾病诊断标准,这一信号仍揭示机体糖稳态调节系统已发出早期警报;空腹血糖受损并非不可逆状态,及时启动以饮食控制、规律运动与体重管理为核心的综合干预,可使约58% 的高风险人群回归正常血糖水平——关键在于将被动监测转化为主动健康管理,在糖尿病前期这一“黄金窗口期”内阻断疾病进程。

